Sammendrag
I forbindelse med udviklingen af en ny metode til bestemmelse af trypsininhibitoraktiviteten i foderstoffer, er der udført en række orienterende undersøgelser med relation til inhibitoraktivitetens eventuelle negative ernæringsmæssige betydning.
Af undersøgelserne fremgik det, at næsten alle typer korn og frø, der anvendes som foder til enmavede dyr, indeholder trypsininhibitoraktivitet, men med en betydelig variation - også inden for det enkelte foderstof.
De højeste aktiviteter blev fundet i frø fra bælgplanter, idet aktiviteten i ubehandlet og toastet soyaskrå blev målt til henholdsvis ca. 20 U/g og 0-2 U/g, medens den i hestebønner og ærter blev målt til 1-2 U/g (i ærtesorten Progreta dog 4-6 U/g), og i lupiner til under 0,1 U/g. Aktiviteten i korn var højest i rug og triticale (ca. 1 U/g), medens byg, hvede og majs kun indeholdt 0,2-0,5 U/g og havre under 0,1 U/g. Aktiviteten i rapsskrå blev målt til ca. 0,3 U/g.
De målte inhibitoraktiviteter var afhængig af hvilken dyreartsspecifik trypsin, der anvendtes. Ved vurderingen af inhibitorernes negative betydning for proteinudnyttelsen, bør inhibitoraktiviteten derfor bestemmes over for trypsin fra den pågældende dyreart.
Trypsininhibitoraktiviteten i hvede og i alle undersøgte bælgplanter var stabil over for pepsin ved pH 2, hvorimod den i rug og triticale hurtigt blev nedbrudt af pepsin. Den relativt høje aktivitet i disse kornarter sammenlignet med hvede kan derfor næppe forklare den dårligere nettofordøjelighed af protein, der ofte er konstateret i rug og triticale.
I varmebehandlede soyaprodukter blev der efter ekstraktion ved pH 9,6 påvist betydeligt mere aktivitet, end ved de mere fysiologisk relevante betingelser ved pH 2 i tilstedeværelse af pepsin.
Indledning
Det har i mange år været kendt, at soyabønner (og soyaprodukter i almindelighed) skal varmebehandles for at kunne anvendes som foder til enmavede dyr. Årsagen hertil skyldes først og fremmest indholdet af trypsininhibitorer i rå soyabønner. Desuden har det vist sig, at en bestemt ærtesort (Progreta) har et relativt stort indhold af trypsininhibitorer, hvilket formodes at være årsagen til en lavere proteinfordøjelighed i denne sort (Medd. nr. 587 og 710). Endelig har det været konkluderet i flere udenlandske undersøgelser, at den dårlige proteinfordøjelighed i triticale i sammenligning med hvede skulle skyldes et relativt højt indhold af trypsininhibitorer.
Trypsininhibitorer er proteiner, der binder sig til fordøjelsesenzymet trypsin, hvorved dets aktivitet hæmmes. De fleste trypsininhibitorer indeholder mange stabiliserende tværbindinger i form af disulfidbroer (cystin-broer). Herved bliver de meget modstandsdygtige over for såvel varme og pH-ændringer, som de øvrige proteinspaltende (proteolytiske) enzymer i mave-tarmkanalen.
Den fysiologiske effekt af trypsininhibitorerne vil umiddelbart være en nedsættelse af proteinfordøjelsen i tyndtarmen, men effekten er dog mere kompliceret, idet koncentrationen af aktivt trypsin i tyndtarmen reguleres hormonelt. Dette betyder, at inhibitorernes kompleksdannelse med trypsin bevirker en øget sekretion af fordøjelsesenzymer fra bugspytkirtlen. Da disse enzymer ligesom inhibitorerne er relativt rige på stabiliserende cystin-broer (for at undgå en for hurtig selvdestruktion i tyndtarmen), bliver resultatet derfor, at der sker et dræn af aminosyrer - især af cystin - fra kroppen.
Den væsentligste effekt af trypsininhibitorerne vil derfor generelt være en nedsat nettofordøjelse af svovlholdige aminosyrer. Dette vil have en særlig stor effekt ved fodring med protein fra bælgplanter, der ikke kun har et lavt indhold af svovlholdige aminosyrer (methionin + cystin), men ovenikøbet har en betydelig del af cystinet bundet i trypsininhibitorer.
I denne meddelelse redegøres for en række orienterende undersøgelse over indholdet af trypsininhibitoraktivitet i almindelige vegetabilske foderstoffer til enmavede dyr. Inhibitoraktiviteten er rutinemæssigt bestemt over for trypsin, der er oprenset fra svin (porcint trypsin). Da imidlertid næsten alle hidtidige undersøgelser vedrørende trypsininhibitoraktivitet, der er angivet i litteraturen, har været udført med trypsin fra kvæg (bovint trypsin), sammenlignes inhibitoraktiviteten over for disse to enzymer. Desuden er der medtaget en række bestemmelser af hæmningen af rottetrypsin. Endelig er den målte aktivitets afhængighed af ekstraktionsbetingelserne undersøgt - herunder indflydelsen af pepsin i ekstraktionsblandingen.
Materialer og metoder
En formalet prøve ekstraheres med en acetatbuffer (0,1 mol/l, pH 5,0) under konstant rystning i 1 time. En del af prøven filtreres og fra filtratet udtages en mindre del til inkubation med trypsin i 10 min., hvorefter trypsinets restaktivitet bestemmes over for et specifikt substrat (DLBAPA) i en buffer ved pH 8,2 og efter inkubation ved 25 grader celsius i 15 min. Resultatet angives i U/g, idet 1 U svarer til hæmningen af aktiviteten fra 1 mg trypsin.
Den nøjagtige mængde aktivt trypsin i såvel præparationer fra svin og kvæg som i ekstrakt fra tyndtarmsindholdet hos rotter blev i forvejen bestemt ved titrering med en standard trypsininhibitor, der hæmmer alle 3 enzymer i forholdet 1:1 mellem trypsin og inhibitor.
Resultater og diskussion
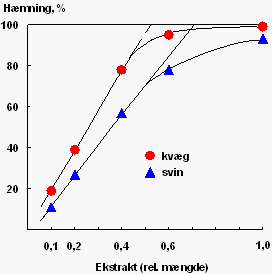
Figur 1 viser hæmningskurver for samme mængde aktivt trypsin fra kvæg og svin med en fortyndingsrække af et inhibitorekstrakt fra ærtesorten Progreta. Det ses, at kurverne ikke er lineære ved en hæmning over 65-75 pct. Tilsvarende hæmningskurver fås for ekstrakterne fra de øvrige undersøgte foderstoffer, idet kurverne altid er lineære op til mindst 55 pct. hæmning. Beregning af inhibitoraktiviteten er derfor altid baseret på målinger, hvor ekstraktet er fremstillet således, at hæmningen af trypsin bliver på 20-60 pct.
Det fremgår også af figur 1, at hæmningen af trypsin fra henholdsvis svin og kvæg ikke er identisk. I tabel 1 er trypsininhibitoraktiviteten i en række frø og korn bestemt over for svinetrypsin og sammenlignet med aktiviteten over for henholdsvis kvægtrypsin og rottetrypsin.
Det fremgår af tabel 1, at kvægtrypsin hæmmes lidt kraftigere af næsten alle inhibitorer, medens rottetrypsin hæmmes kraftigere af inhibitorer fra bælgplanter, men til gengæld svagere af inhibitorer fra kornarterne. Det kan derfor konkluderes, at den bedste vurdering af trypsininhibitorernes effekt på foderets proteinudnyttelse fås ved at måle hæmningen af det artsspecifikke trypsin, der stammer fra den dyreart, som foderet er beregnet til.
|
Figur 1. |
Hæmningskurver for samme mængde trypsin fra henholdsvis kvæg og svin med forskellige fortyndinger af ekstrakt fra ærtesorten Progreta |
|
Tabel 1. |
Trypsininhibitoraktiviteten (U/g) i udvalgte foderstoffer efter ekstraktion ved pH 5 og målt over for trypsin fra forskellige dyrearter |
||||
|
Trypsinets oprindelse |
|||||
|
Foderstof |
kvæg |
rotte |
svin |
||
|
Byg |
0,7 |
0,5 |
0,6 |
||
|
Rug |
1,0 |
0,3 |
0,9 |
||
|
Triticale |
0,9 |
0,4 |
0,8 |
||
|
Hvede |
0,4 |
0,2 |
0,4 |
||
|
Havre |
0,1 |
0,0 |
0,0 |
||
|
Soyaskrå |
19,5 |
26,0 |
20,8 |
||
|
Ært (Stehgolt) |
1,9 |
1,9 |
1,1 |
||
|
Ært (Progreta) |
6,0 |
6,6 |
4,5 |
||
|
Hestebønner |
1,9 |
1,3 |
1,0 |
||
|
Lupin |
0,1 |
0,0 |
0,0 |
||
|
Figur 2. |
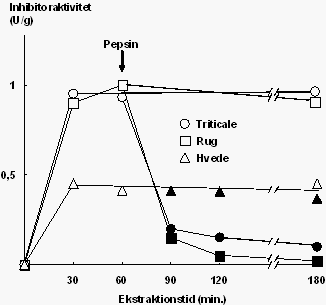
Inhibitoraktivitet i ekstrakt fra forskellige kornarter over for trypsin fra svin efter ekstraktion ved pH 2 med tilsætning af pepsin efter 1 time (fyldte symboler) eller uden tilsætning (åbne symboler) |
Effekten af pepsin på inhibitoraktiviteten fra forskellige kornarter blev undersøgt ved at inkubere med svinepepsin ved fysiologisk relevante betingelser (pH 2,0 og 0,05 mg pepsin/ml). Det fremgår af figur 2, at i løbet af 2 timer blev inhibitoraktiviteten herved nedbrudt fuldstændigt i rug og ca. 90 pct. i triticale, medens den var stabil i hvede.
Disse resultater viser tydeligt, at selv om hvede indeholder mindre trypsininhibitoraktivitet end rug og triticale, vil inhibitorerne fra hvede sandsynligvis have en større virkning i tyndtarmen end inhibitorerne fra rug og triticale, da størstedelen af aktiviteten fra de sidstnævnte må formodes at blive nedbrudt af pepsinet i maven.
Det er derfor ikke særligt sandsynligt, at den lavere fordøjelighed. der generelt konstateres af proteinet i rug og triticale, sammenlignet med hvede, skyldes trypsininhibitorer, som det tidligere har været foreslået.
Tilsvarende undersøgelser over inhibitoraktiviteten i frø fra bælgplanter viste, at ekstraktion ved pH 2 generelt gav lidt højere værdier end ved pH 5, og at tilsætning af pepsin til ekstraktionsvæsken øgede den ekstraherede aktivitet yderligere (tabel 2). Disse resultater viser, at inhibitorerne i bælgplanter er stabile over for pepsin under de givne betingelser og ovenikøbet ekstraheres bedre efter pepsinets delvise nedbrydning af de øvrige proteiner i frøene.
|
Tabel 2. |
Ekstraktionsbetingelsernes indflydelse på målte værdier af inhibitoraktiviteten (U/g) over for svinetrypsin i udvalgte foderstoffer |
||||
|
Ekstraktionsbetingelser |
|||||
|
Foderstof |
pH 5 |
pH 2 |
pH 2 + pepsin |
||
|
Byg |
0,6 |
0,5 |
0,3 |
||
|
Rug |
0,9 |
0,8 |
0,0 |
||
|
Triticale |
0,8 |
0,8 |
0,1 |
||
|
Hvede |
0,4 |
0,4 |
0,4 |
||
|
Soyaskrå |
20,8 |
22,7 |
23,4 |
||
|
Ært (Stehgolt) |
1,1 |
1,0 |
1,3 |
||
|
Ært (Progreta) |
4,5 |
4,7 |
5,2 |
||
|
Hestebønner |
1,0 |
1,2 |
1,4 |
||
Effekten af varmebehandlingen på soyaprodukter er tidligere (og bliver undertiden stadigvæk) vurderet på grundlag af en semikvantitativ bestemmelse af restaktiviteten fra urease. Der er dog kun en lille sammenhæng mellem denne aktivitet og restaktiviteten fra trypsininhibitorerne. Restaktiviteten måles derfor nu ofte over for kvægtrypsin efter ekstraktion ved pH 9,6. Denne metode er oprindeligt foreslået af American Oil Chemists, Society til anvendelse specielt ved bestemmelse af restaktiviteter i varmebehandlede soyaprodukter.
|
Tabel 3. |
Ekstraktionsbetingelsernes indflydelse på målte værdier af inhibitoraktiviteten (U/g) over for kvægtrypsin i kinesiske soyaprodukter med ukendt forbehandling |
||||||||
|
Ekstraktionsbetingelser |
|||||||||
|
Soyaprodukter |
pH 9,6 |
pH 5 |
pH 2 |
pH 2 + pepsin |
|||||
|
*) |
|||||||||
|
A |
23,6 |
29,8 |
25,6 |
28,7 |
25,0 |
||||
|
B |
21,7 |
16,5 |
16,8 |
13,3 |
13,9 |
||||
|
C |
15,7 |
9,1 |
11,8 |
15,4 |
9,7 |
||||
|
D |
13,3 |
12,6 |
16,2 |
18,5 |
13,4 |
||||
|
E |
10,1 |
6,3 |
11,1 |
14,3 |
11,6 |
||||
|
F |
2,1 |
0,0 |
0,2 |
0,3 |
0,2 |
||||
|
G |
1,1 |
0,0 |
0,2 |
0,4 |
0,3 |
||||
|
*) aktiviteten målt over for svinetrypsin |
|||||||||
I tabel 3 er sammenstillet resultaterne fra bestemmelse af trypsininhibitoraktiviteten (i U/g prøve) i en række soyaprodukter fra Kina med ukendt forbehandling, idet den officielle ekstraktionsmetode er sammenlignet med de ovenfor beskrevne. Det fremgår af tabellen, at de bedste ekstraktionsbetingelser helt afhænger af prøven. Dog ser det ud til, at prøver, der er tilstrækkeligt varmebehandlede (F og G), ekstraheres bedst ved pH 9,6, idet der næsten ingen aktivitet ekstraheres ud ved pH 5 i disse prøver.
Ved pH 2 ekstraheres der lidt aktivitet og ved tilsætning af pepsin øges aktiviteten yderligere, men er stadig betydeligt lavere end ved pH 9,6. Da dette pH imidlertid er væsentligt højere end det fysiologiske område (2-4 i maven og 6,5-7,5 i tyndtarmen), kan man stille spørgsmål ved, hvor meget de opnåede værdier efter ekstraktion ved pH 9,6 reelt betyder for en evt. nedsættelse af proteinudnyttelsen. Det kan således ikke udelukkes, at en negativ virkning er bedre korreleret til den aktivitet, der bliver ekstraheret ud ved pH 2 i tilstedeværelse af pepsin.
Afklaring af såvel dette spørgsmål, som af hvor meget restaktivitet, der må være tilbage, for at der ikke længere er nogen målelig negativ effekt på proteinudnyttelsen hos enmavede dyr, må imidlertid afvente nærmere undersøgelser med fordøjelses- og balanceforsøg.